生科院邱小波教授合作揭示结核分枝杆菌抑制宿主固有免疫的全新泛素化修饰酶
2021-05-06 浏览次数:
结核病是由结核分枝杆菌(Mtb)引起的古老疾病。2019年全球约有1000万新发患者,约有141万人死于该病。结核分枝杆菌编码的关键病原蛋白丝/苏氨酸蛋白激酶(PknG)在其感染过程中可被分泌至宿主细胞的胞质中,干扰宿主固有免疫信号通路。邱小波教授最近与中科院微生物所刘翠华研究员和高福院士合作发现PknG可作为泛素(Ub)激活酶(E1)、去泛素化酶(DUB) 和泛素连接酶(E3)促进宿主细胞中肿瘤坏死因子受体相关因子2(TRAF2)和TGF-β激活激酶1(TAK1)的泛素化和降解, 从而抑制宿主NF-κB 信号通路和固有免疫(Wang et al., EMBO Reports, online)。PknG 催化泛素与泛素耦合酶 (E2) UbcH7 以异肽键结合 (UbcH7 K82-Ub isopeptide bond), 而不是通常的硫酯键(C86-Ub thiol-ester bond)。随后,PknG又作为去泛素化酶(DUB)将泛素从与UbcH7形成的中间产物中释放出来并转移至其底物TRAF2和TAK1。PknG的蛋白激酶活性中心的氨基酸序列与人类的相关激酶高度相似,不宜作为药物靶点,而其泛素相关活性中心的序列没有发现与人类蛋白的同源性。因此,PknG泛素修饰活性位点可能为抗结核新药设计提供全新的理想靶点。
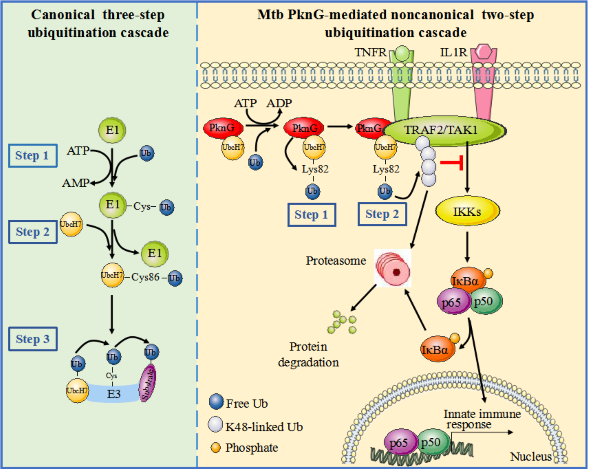
图1. MtbPknG通过催化非经典的泛素化反应抑制宿主固有免疫的模式图
该研究首次发现了Mtb 中PknG具有E1、DUB、E3三重活性并可靶向宿主固有免疫系统中关键蛋白(TRAF2和TAK1)。揭示了泛素化过程可以由非经典的级联反应催化实现。经典的泛素化修饰是一个由E1、E2和E3依次催化的三步酶促级联反应。PknG通过其新型的类泛素(Ubl)结构域与E2蛋白UbcH7互作,并作为E1促进Ub与UbcH7的共价结合,同时可进一步利用其DUB活性催化Ub自UbcH7-Ub解离以获得活化的Ub。令人惊奇的是,PknG直接催化Ub以异肽键的形式结合至UbcH7的Lys82位点,而非形成经典Cys86位点由硫酯键连接的PknG-Ub中间体。最后,PknG可作为E3将活化的Ub转移至底物蛋白上而完成泛素化(图1)。
相关研究结果已在线发表于EMBO Reports,题为“M. tuberculosis protein kinase G impairs host immunity by acting as an unusual ubiquitinating enzyme”。 中国科学院微生物研究所刘翠华研究员团队的汪静、葛浦浦和雷泽慧为共同第一作者,刘翠华研究员、yl6809永利官网邱小波教授以及中国科学院微生物所高福院士为共同通讯作者。该研究得到国家自然科学基金委项目、中国科学院战略性先导科技专项(B类)、国家重点研发计划项目、国家科技重大专项以及中国科学院青年创新促进会人才项目的资助。
文章链接:http://doi.org/10.15252/embr.202052175
