生科院王占新教授课题组与合作实验室在Science Advances上发表文章揭示新型CpG岛结合蛋白SAMD1参与表观遗传调控的分子机制
2021-05-17 浏览次数:
CpG岛是高等脊椎动物基因组上的重要调控序列,富含非甲基化的CpG基序,与多数基因的启动子重合。CpG岛既可以招募转录激活因子,也可以招募转录抑制因子。CXXC结构域是第一类被发现能够特异识别CpG岛上非甲基化CpG基序的结构域,含有CXXC结构域的蛋白如CFP1、KDM2B等分别介导了激活和抑制相关复合物在CpG岛上的招募。2017年yl6809永利官网王占新实验室与合作者发现PCL家族蛋白的WH结构域是一类新型结合CpG岛的结构域(Nature,2017),PCL家族蛋白通过其WH结构域帮助PRC2复合物招募到基因组的CpG岛上。尽管如此,目前已知的CpG岛结合蛋白还很有限,与CpG岛相关的基因表达调控还有很多尚待研究。
2021年5月13日,王占新实验室继续与德国马尔堡大学的Robert Liefke实验室合作,在线发表题为The SAM domain-containing protein 1 (SAMD1) acts as a repressive chromatin regulator at unmethylated CpG islands的文章,发现SAMD1是一个新的CpG岛调控因子,通过其非典型WH结构域招募到CpG岛上参与表观遗传调控。
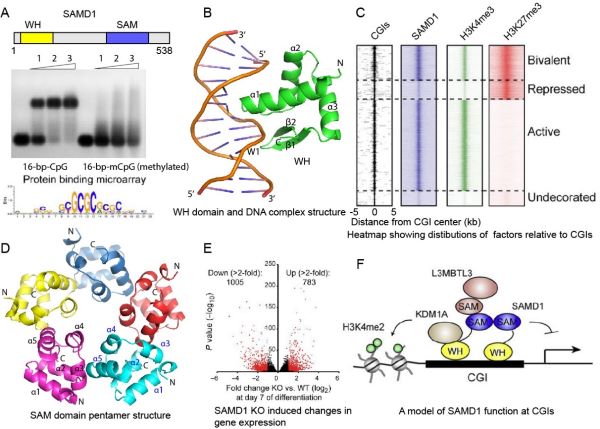
SAMD1又称为Atherin,是染色质结合蛋白,对其生理功能的研究甚少。SAMD1的N端含有一个非典型的WH结构域,C端含有一个SAM结构域(图1A)。该研究发现SAMD1的WH结构域特异识别含有非甲基化CpG基序的DNA,而DNA甲基化则会大大减弱这种结合(图1A)。SAMD1倾向于结合含有GCGC基序的DNA(图1A),结构分析表明其WH结构域不仅识别DNA大沟中的CpG基序,还与DNA小沟结合(图1B)。这种DNA结合方式是一种新型的DNA结合方式,不同于之前发现的PCL蛋白的WH结构域结合DNA的方式。组学分析表明SAMD1选择性的结合在富含H3K4me3组蛋白修饰基因表达活跃的CpG岛上(图1C),但是总体表现为抑制因子的作用。分析SAMD1所结合的内源蛋白发现SAMD1与组蛋白去甲基化酶KDM1A和L3MBTL3等蛋白有相互作用,主要通过KDM1A对所调控的基因起抑制作用。
SAMD1的功能不仅仅依赖于其N端的WH结构域,其C端的SAM结构域对SAMD1有效结合染色质及发挥抑制功能也是必须的。SAMD1的SAM结构域既可以自聚成5元环状结构(图1D),又可以与其它含有SAM结构域的蛋白如L3MBTL3异源聚集形成多聚复合物,协同SAMD1稳定的结合在染色质上。在小鼠胚胎干细胞的分化过程中,SAMD1的敲除会影响多个基因的表达(图1E),表明其在干细胞的分化中起着重要作用。总结一下,该工作发现SAMD1是一个新的结合CpG岛的转录调控因子,其N端的WH结构域和C端的SAM结构能够分别结合DNA和互作蛋白,协同行使抑制功能(图1F)。该研究丰富了对CpG岛相关基因表达调控的认识,并为进一步研究SAMD1的生理功能奠定基础。
德国马尔堡大学的助理教授Robert Liefke与yl6809永利官网的王占新教授为本文的共同通讯作者。Liefke实验室的博士后Bastian Stielow和王占新实验室的博士生周宇乔和曹英华为本文的共同第一作者。哈佛大学的Martha Bulyk教授和施扬教授为本项目提供了重要支持。该研究获得了德国DFG和Fritz-Thyssen基金,中国自然科学基金和美国NIH等基金的资助,上海同步辐射光源和yl6809永利官网分析技术中心为本工作提供了重要的技术支持。
图1. SAMD1通过其WH结构域招募到CpG岛上参与表观遗传调控
文章的链接:https://advances.sciencemag.org/content/7/20/eabf2229